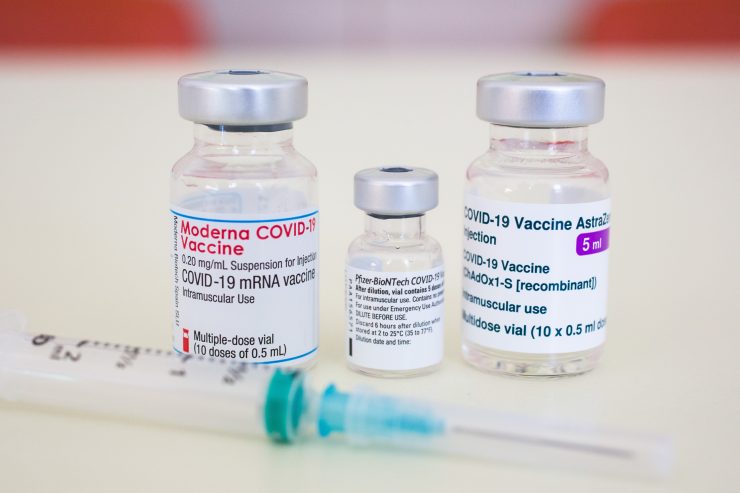
EMA habe von dem US-Pharmakonzern einen Antrag auf bedingte Marktzulassung erhalten, dieser werde nun beschleunigt geprüft, teilte die Behörde gestern mit. In der Europäischen Union haben bislang die Covid-19-Impfstoffe von BioNTech/Pfizer, Moderna sowie von AstraZeneca eine bedingte Marktzulassung erhalten. Gleichwohl kommt die Impfung der Bevölkerung nach wie vor nur schleppend voran, auch wegen zeitweiliger Lieferprobleme der Hersteller. Der EU-Kommission war zudem vorgeworfen worden, nicht frühzeitig genügend Impfstoff bestellt zu haben. Bei J&J hat sich die EU bis zu 400 Millionen Dosen gesichert.
Im Vergleich zu den anderen schon zugelassenen Impfstoffen bietet der von J&J den Vorteil, dass eine einmalige Dosis ausreichen soll statt zwei Dosen. Zudem muss das Präparat auch nicht tiefgefroren gelagert werden, was die Verteilung erleichtert. J&J hatte Ende Januar für das Mittel eine Wirksamkeit von insgesamt 66 Prozent in seiner weltweiten Untersuchung mit rund 44.000 Teilnehmern gemeldet.
Während das Vakzin eine höhere Wirksamkeit von 72 Prozent in der Studie in den USA zeigte, lag diese in Südafrika aber nur bei 57 Prozent. Dort geht allerdings die ansteckendere Variante B.1.351 um, auf die nach Angaben von J&J nahezu alle festgestellten Infektionen in seiner Studie in dem Land zurückzuführen waren. Die US-Gesundheitsbehörde FDA hatte einen Mindestwert von 50 Prozent für eine mögliche Zulassung festgelegt, in den USA beantragte J&J Anfang Februar eine Notfallzulassung.
J&J hatte sich bei seiner Studie als Hauptziel die Prävention von mittelschweren bis schweren Covid-19-Verläufen gesetzt – der Impfstoff war demnach über alle Regionen zu 85 Prozent wirksam, um schwere Krankheitsverläufe zu stoppen und Einweisungen ins Krankenhaus zu vermeiden.
„Hera-Inkubator“
Die EU-Kommission startet am Mittwoch ein Programm zur besseren Erforschung von Mutationen des Coronavirus. Beim Programm „Hera-Inkubator“, das heute gestartet wird, werden Labore, Gesundheitsbehörden, Wissenschaftler und die EU-Kommission mit dem Ziel zusammengebracht, Mutationen des Coronavirus besser zu erforschen. Dafür plane Brüssel den Einsatz „erheblicher zweckgebundener Mittel“, sagte Kommissionschefin Ursula von der Leyen in einem gestern veröffentlichten Interview mit der französischen Zeitung Les Echos. Die EU will so bei der Entwicklung von Impfstoffen helfen, die auch gegen neue Coronavirus-Varianten helfen.
Es gehe darum, den Corona-Impfstoffherstellern zu helfen, „Produktionskapazitäten für Impfstoffe der zweiten Generation zu entwickeln“, sagte von der Leyen. Die bereits aufgetretenen Varianten des neuartigen Coronavirus „beunruhigen uns sehr“, fügte sie hinzu. „Das Virus verändert sich und wird dies weiter tun“, sagte eine Kommissionssprecherin. „Es ist wichtig, dass wir uns auf das mögliche Auftauchen neuer Varianten vorbereiten.“ Denn diese könnten es notwendig machen, die Menschen erneut zu impfen, damit sie auch gegen die Virus-Mutanten immun seien.
In Europa hatten sich in den vergangenen Wochen vor allem Varianten aus Großbritannien und Südafrika ausgebreitet, die ansteckender sind als das bisherige Coronavirus. Die neuartigen Impfstoffe von BioNTech/Pfizer und Moderna bieten auch vor diesen Varianten Schutz. Bei der südafrikanischen Variante ist die Wirksamkeit zwar etwas geringer, aber aus Sicht der Hersteller ausreichend.
Beim dritten in der EU zugelassenen Impfstoff von AstraZeneca scheint die Wirkung aber deutlich niedriger zu sein. Die südafrikanische Regierung hatte jedenfalls nach einer entsprechenden Studie entschieden, auf den Einsatz des Impfstoffes zu verzichten.
Brüssel hatte bereits im vergangenen Jahr die Gründung einer neuen Behörde für Gesundheitsnotfälle (Hera) angekündigt, durch die es gelingen soll, künftigen Pandemien entgegenzuwirken und eine bessere Zusammenarbeit zwischen den Mitgliedstaaten zu erreichen. Hera soll zudem die Kooperation zwischen dem öffentlichen und privaten Sektor im Kampf gegen Corona verstärken.
Mit der neuen Behörde soll sich auch der Sondergipfel der EU-Staats- und Regierungschefs in der kommenden Woche befassen. Ihre Gründung dürfte anders als die Schaffung des „Hera-Inkubator“-Programms einen längeren Vorlauf benötigen. Sie muss nach einem Vorschlag der Kommission auf dem Gesetzgebungsweg durch die Mitgliedstaaten und das Europaparlament beschlossen werden. (Reuters/AFP/Red.)

 De Maart
De Maart






Sie müssen angemeldet sein um kommentieren zu können